再完美的生命周期管理也不能替代新药研发
很实用的一本书,让我了解了很多关于药品生命周期管理的基础知识和原理,也看到了和我司相关一些案例。
再完美的生命周期管理也不能替代新药研发
定义:
“晚期生命周期管理”(late-stageLCM),简称为LLCM。
新分子实体(NME,newmolecularentity)
小型生物科技公司相比大型制药公司有更好的创新纪录
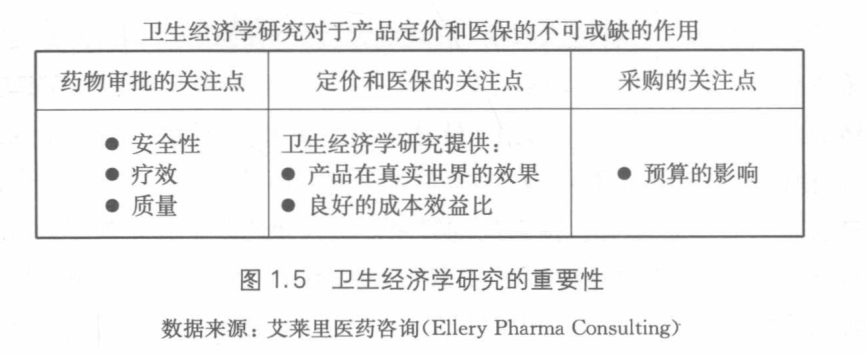
市场竞争
在专利过期或产品受到仿制药公司的侵袭时,公司必须同其他生产 同一分子的仿制药公司进行竞争。
第一是分子水平。
第二是药品的类别水平。公司必须与推广同一类别的其他分子产品的公司进行竞争。
第三是疾病领域。公司必须与治疗同一疾病的其他解决方案的公司进行竞争。

多元化
由于新药开发变得越来越艰难,一些品牌药公司正在尝试业务多元化发展,以避免过 多依赖处方药业务,这样可以摊薄风险。是否要跟随这一潮流?多元化发展离核心业务要 多远?这些问题是很多大型和中型制药公司都迫切需要回答的问题。
诺华的仿制药子公司山德士(Sandoz)是仅仅位 列以色列仿制药巨头梯瓦(Teva)之后的全球第二大仿制药公司。
紧接着,在2010 年5月,赛诺菲安万特公司又通过和在日本市场领先并快速增长的仿制药公司日医工株式 会社(Nichi-Iko)组成合资公司,进一步加强了其在日本仿制药市场的地位。赛诺菲安万特 拥有这家合资公司51%的股权。
多元化发展的全球典范非强生莫属。它的产品线包括的品牌有强生婴儿(Johnson’s BabyCare)、PizBuin防晒霜、邦迪(BandAid)、李施德林(Listerine)、Carefree女性健康用 品、o.b.女性护理卫生用品、感冒药泰诺(Tylenol)、治疗烧心感的药物Pepcid、降脂功能性 食品Benecol、隐形眼镜安视优(Acuvue)、Depuy骨科器械、心血管介人产品Cordis、爱惜康 外科产品(Ethicon)、LifeScan血糖仪、Ortho临床诊断产品、芬太尼透皮贴剂多瑞吉(Duragesic)、精神分裂症治疗药物维思通(Risperdal)、生物制剂类克(Remicade)等,不一而 足。2011年4月,强生公司宣布以210亿美元收购骨科设备、植人物和生物材料的生产商 辛迪思公司(Synthes)。
消费者心智
典型比例
可以将消费者 分为五大类。这五组消费者通常被冠以“创新者(Innovator)”,“早期接受者(Early adopters)”,“早期众多跟进者(Earlymajority)”,“后期众多跟进者(Latemajority)”和“滞 后者(Laggards)”的名称
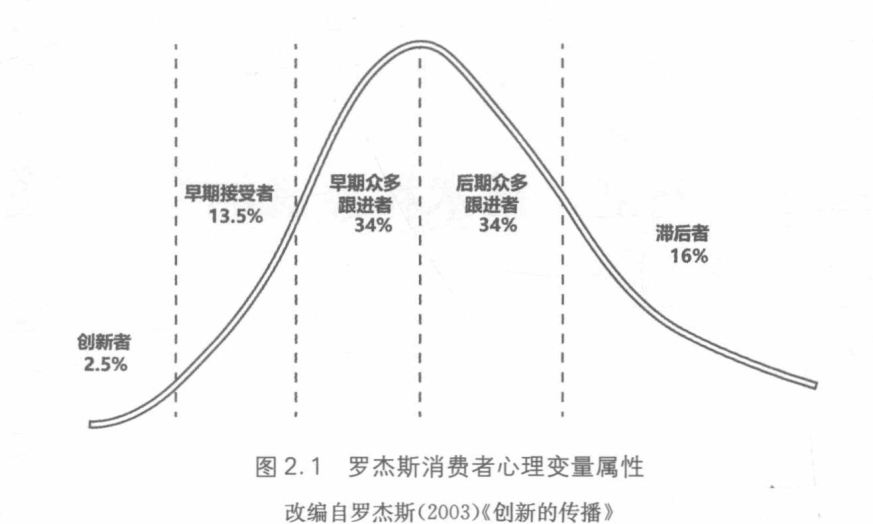
红色是一般消费品,黑色是普药
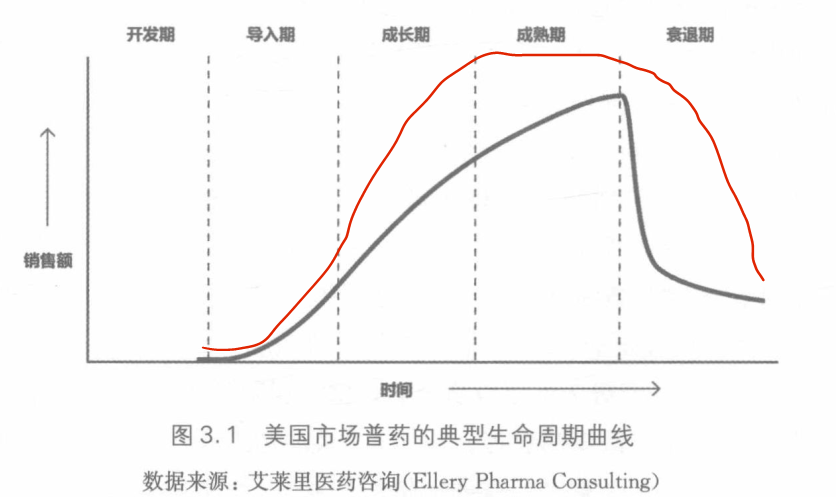
制药行业有如下四个对生命周期管理有影响的特点:
(1)药物生产过程本身较为容易。
大多数药物的生产工艺简单,生产成本低廉,因此就 生产过程本身而言,其进人壁垒较低。对于定价高昂的品牌药而言,其生产成本仅占销售 金额的一小部分。创新者为证明一个新分子有效而安全需要耗费巨资进 行临床研究,但仿制药公司并不需要在这方面投资,只需要证明其仿制的产品在体内有相 同功效,即有生物等效性(Bioequivalent)即可。这即是仿制药生产商赖以生存的基础。 1984年Hatch-Waxman法案中提及的“生物等效性”这一概念,是造成其后在美国市场仿制 药行业飞速发展的原因。(2)专利制度防止仿制药进人市场。
(3)消费者并不直接为药品支付费用。
原因很简单,就是在很多情况下, 药品的最终使用者并不能作购买决策。处方药行业的品牌价值远低于消费品行业的品牌。
(4)政府为药品定价并支持仿制药。
曲线原因
3.1.1成长期较慢的增长速度
其原因是什么? 在药物充分体现其价值之前,可以理解医生开处这些药物时所存在的顾虑。
除此之外,药物在被批准上市之前不能作大范围的推广工作。
药物在上市之初增长较为缓慢的另一个原因是,现在开发的药物越来越多是生物制 剂,或机理复杂的小分子药物。这些药物有多个适应证,而这些适应证会在药物的生命周 期中次第上市。
3.1.2缺乏一个真正的成熟期
很多药物都没有一个真正的成熟期,即没有一个销售额的平台期,而是销售额会不断 上涨直到销量突然下降。这一现象的原因是,当品牌药专利过期,或仿制药生产商挑战专 利成功,而紧接着很多廉价的仿制药上市,此时品牌药往往还在其成长期,但是产品销量会 急剧下滑。在更多的时候,并不是品牌专利过期才会启动衰退期。
3.1.3 急遽的衰退期
有一个需要澄清的错误观点是仿制药公司不喜欢进人壁垒高的产品。有些仿制药公 司还主动刻意寻求那些进人壁垒高的产品,因为对于一个仿制药公司而言,作为市场上唯一的、或少数几个之一的仿制药能让它获得超高的利润、较高的市场份额,而且这一领域的 价格竞争也可能并不激烈。
(1)更快的市场导入; (2)更陡的增长曲线; (3)更短的时间达到销售峰值; (4)更高的销售峰值; (5)更长的市场独占期;(6)市场独占期过后更缓慢的销售滑坡; (7)市场独占期过后更高的市场份额。
第二部分 生命周期管理的法律和 行政审批环境
美国
美国《联邦食品药品和化妆品法》第505节认可三种不同的新药申请种类:
(1)药品申请包括疗效和安全性实验的完整报告(第505(b)(1)节)。这类申请即称之 为“新药申请”(NewDrugApplication,NDA)。(2)药品申请包括疗效和安全性实验的完整报告,但是至少部分上市批准所要求的信 息并非来自由申请人所做的试验,而是来自于申请人所引用的文献(第505(b)(2)节)。
(3)药品申请包含的信息能显示申请上市的产品和一个先前已被批准的产品是完全相 同的(第505(b)(j)节)。这些申请即被称为“简略新药申请”(AbbreviatedNewDrug Application, ANDA)。
仿制药申请之所以被称为“简略申请”,是因为它们基本上不需要临床前资料(动物实 验)和临床资料(人体实验)来建立安全性和有效性。
如下是FDA要求仿制药必须达到的全部要求:
·仿制药必须和原研药具有同样的有效成分和相同的剂量。
·仿制药必须和原研药有相同的剂型(例如片剂或溶液),和相同的给药途径。
·仿制药生产商必须证明仿制药和原研药具有生物等效性,即仿制药必须和原研药一 样在相同时间内将相同剂量的有效成分导人病人血液。
·仿制药的标签必须和原研药的标签基本一致。
·仿制药生产商必须完整记录和存档仿制药的化学特性、生产过程步骤以及质量控制 方法。 ·仿制药公司必须使FDA确信所有的原料和成品都符合为药物设定纯度标准的机 构,即美国药典的要求。
·仿制药公司必须显示,在标签标明的失效日期之前,仿制药都要保持其效度并且保持 不变。
·仿制药公司必须符合药品生产质量管理规范(GMP)的联邦法规的规定,并且要给 FDA提供生产处理、检验、包装和为药物作标签所用设施的完整描述。FDA会对生产设施 进行检查以确保符合规定。品牌药公司只能享受一次为期30个月的审评暂停,并且只有那些在第一个仿制 药公司递交ANDA时已列在橙皮书中的专利才能享有这个30个月审评暂停。
欧洲
在欧洲有四种药品审批程序。一个药品在多于一个国家获得上市许可一定要通过下 面三种审批程序中的一种进行申请:
- “集中审批程序”(CentralisedProcedure,CP),相互认 可程序(MutualRecognitionProcedure,MRP)和
- “分散审批程序”(Decentralised Procedure,DCP)。“分散审批程序”是相对较新的一种审批程序。它于2005年11月开始, 由更新的欧盟药品指令开始执行。
- 如果公司只想在一个国家上市其产品,它可以采用“成 员国审批程序”(NationalProcedure)。 集中审批程序集中审批程序由总部在伦敦的欧洲药品管理局(EuropeanMedicines Agency,EMA)执行。它是一种独立申请。这一申请一旦批准,产品即可在欧盟所有成员 国上市。所有生物制剂、孤儿药、艾滋病药、肿瘤药、神经退行性变疾病药、糖尿病药、自体 免疫性疾病和病毒感染的治疗药物都被强制要求采用这一程序。
日本
日本和欧洲一样,都没有对首仿药的180天市场独占期,这一点和美国市场 不同。由于人力资源瓶颈的原因,日本仿制药的审批时间较长。因此,往往在专利失效几 个月甚至几年后,仿制药才能上市。仿制药上市的延迟造成了不必要的医疗成本的上升, 日本政府已在着手处理这一问题。
非专利知识产权
商标、商业外观权(TradeDressRights,商业外观权保护产品的商业设计不受侵犯,包括形 状、外形、样式、颜色、药片的三维形态以及其包装)、版权、因特网网址、技术诀窍
孤儿药
制药公司开发孤儿药是为了治疗罕见病又称为“孤儿病”。有些政府为公司提供适当 的激励以鼓励其投人资源开发这类药物。政府这样做的原因是如果没有这些激励,公司就 不能通过开发罕见病的药物以赢利,也就使罕见病没有合适的治疗手段。政府提供的激励 有多种形式,为其提供市场独占权是其中之一。政府通常对于孤儿药的定价和医保也有相 应优惠政策。每个国家提供的激励各有不同,孤儿药独占期的长度亦复如是。
儿科用药独占权
在欧洲和美国,还有一种情况能获得独占期延长,即儿科用药独占权。让我们首先看 一下美国的情形,美国是首先引人这一概念的国家。
具体生命周期管理策略
研发策略
研发阶段生命周期管理主要有四大原则: ·能够对该产品的临床数据和资料做有意义的改进。 ·能够增加该品牌在真实世界中应用的潜在病人基数。 ·能够使研发阶段生命周期管理项目达到较高的投资回报率。 ·能够通过专利保护和行政手段以进一步保护该品牌的市场独占权。
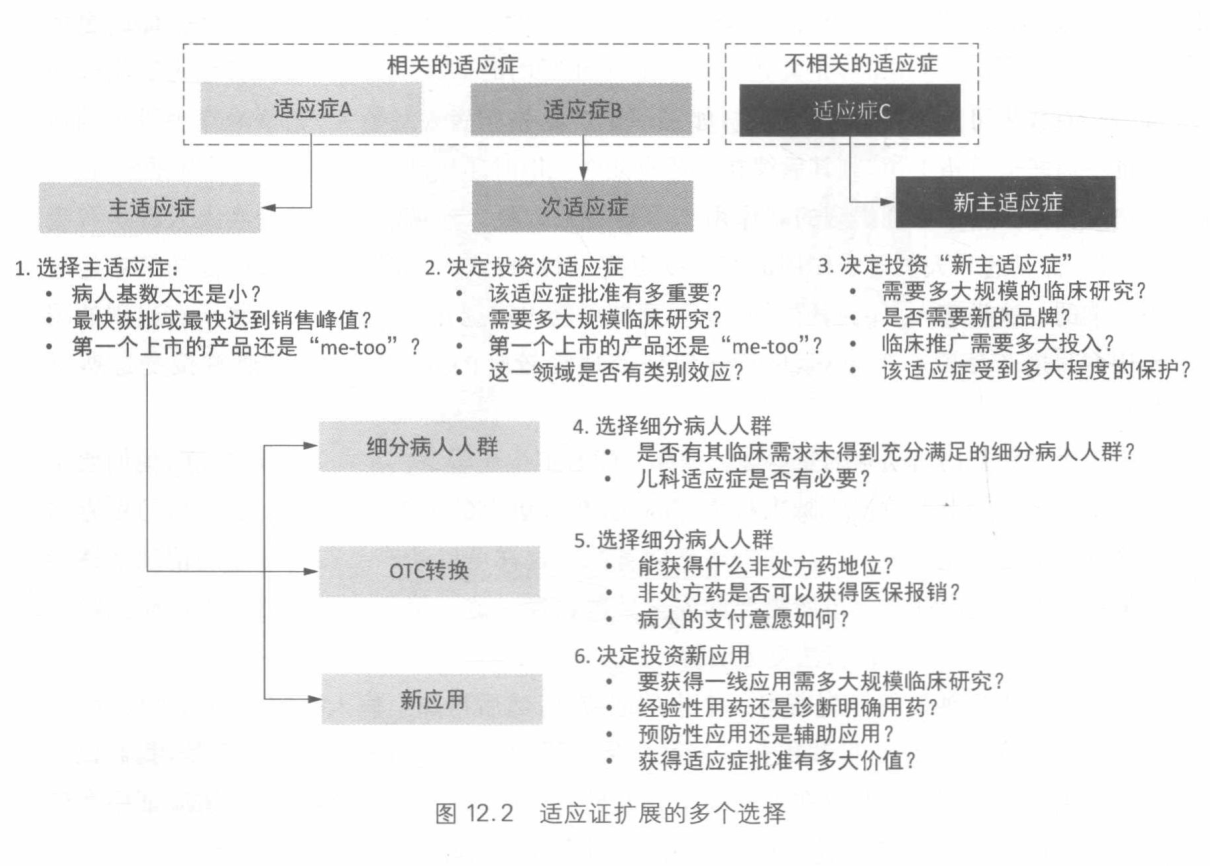
适应症扩展
适应证扩展是产品生命初期和中期最有效的生命周期管理方法。如果一个新分子实 体可以针对多个适应证,那么这些适应证的先后次序也是生命周期管理策略中的至关重要 的内容。
适应证扩展的类型
相同医生,相同疾病
例如,一个药物在和另一个药物联用时能更有效,更安全地治疗 一个疾病,那么一个固定剂量复方制剂能使其在治疗阶梯中更上一层,比如原先只能治疗 轻中度的某一疾病,新适应证则可以治疗重症,这样就扩大了其应用范围。
相同医生,不同疾病
肿瘤药物的适应证扩展常常属于这种类型。一个很好的例子是 罗氏的安维汀(Avastin),它最初获得的适应证是结肠癌和肺癌,而在欧洲,它还有治疗恶性 胶质瘤(glioblastoma)和乳腺癌的适应证。
不同医生,相同疾病
立普妥(Lipitor)的案例就属此类。2004年以前,立普妥的适应 证是高胆固醇和高甘油三酯血症。2004年,它又获得了预防2型糖尿病病人发生卒中和心 肌梗死的适应证,因此又增加了在糖尿病科医生应用该药物的机会。增加新剂量可以是处于成长期的品牌行之有效的策略。这些新剂型能帮助医生针对 病人的需求定制其剂量
在过去的20年,给药物增加新剂型是最常用的生命周期管理策略。这一策略被广泛用 于成长期、成熟期和衰退期的各种产品。在管理文章和各种生命周期管理论坛中描述的很 多案例都基于这一策略。同一活性成分能被制成多重剂型。很多次级专利都是剂型的专 利,而这些专利通常比其分子实体的专利更晚过期。
给药装置和复方制剂
在过去的几十年中,很多治疗领域的竞争态势往往由给药装置所决定。在呼吸系统领 域,葛兰素史克、阿斯利康、勃林格殷格翰、辉瑞和诺华都在不遗余力地研发新的吸人装置, 而在很多时候,这些装置中的药物则差异化较小。在这一领域,一个值得关注的公司是仿 制药巨头,以色列公司梯瓦制药(Teva),因为它也十分专注于开发下一代吸人装置。第一 代吸人性胰岛素品牌Exubera失败的一个重要原因就是其操作繁复而体积庞大的吸人装 置,它看起来更像是潜水呼吸装置而不是药物吸人装置。 很多注射药物都瞄准注射装置作为其产品差异化的主要手段。在糖尿病治疗领域,给 药装置从玻璃瓶加注射器,到预充注射器,再到胰岛素笔不断演变。其背后的创新推动力 来自市场领导者赛诺菲(Sanofi)和诺和诺德等公司,他们借助给药装置的演进能更好地满 足病人需求,同时进一步稳固其市场领先地位。我们在第26章讨论生物药品的生命周期管 理策略时还会详细探讨注射装置的作用。 胰岛素泵已经有很多年的应用经验,并日益在糖尿病治疗中扮演越来越重要的角色。 结合动态血糖监测和按需胰岛素注射的“人工胰腺”(Artificialpancreas)技术在未来的10 年内也很有可能成为现实。制药行业分析人士指出未来数年中,给药装置的增速要远高于 药物市场的增速,这也将给药品生命周期管理带来新的手段和机遇。
开发复方制剂的策略以前通常都在产品生命成长期和成熟期执行。
多重适应证固定剂量复方制剂的终极产品是被称为“多效药片”(Polypill)的产品。自 从2009年印度的“多效药片”研究发布后,这一产品受到市场的极大关注。这样的多效药片在西欧和美国审批的门槛很高,因此几乎不可能上市。
化学修饰
对品牌药品的有效成份进行化学修饰传统上说是生命周期管理最重要的策略之一。 本章的题目为“第二代产品和化学修饰”,它覆盖范畴相当广泛的不同策略。
新类别,同一疾病
公司为了更好地利用其在某一疾病领域已建立的资源,开发或者 引进一个完全不同的新分子实体。由于公司已经被市场认为是这一领域的领导者,并已建 立大量的关系资源,在这一领域继续做大做强是个风险较低的策略选择。同一类别,新疾病公司
充分利用其在某一类药物开发中的优势,开发这一类别中的 新药以治疗一种新的疾病。同一类别,同一疾病
公司开发一个新分子实体以代替现有产品。第二个案例可能是近年来生命周期管理史上最成功的案例。阿斯利康公司成功地在 洛赛克(奥美拉唑)的专利过期之前,将病人转换到奥美拉唑的左旋异构体一埃索美拉唑 (商品名为耐信),极大地延续了其在质子泵抑制剂领域的无可争辩的优势。
晶体多态
多态性是固体物质可以以两种或以上的晶体形态存在的现象。一种物质结晶过程中 有多种因素会导致其结晶出现多态性,其中包括: ·溶媒 ·过饱和程度 ·杂质的存在 ·湿度 ·搅拌的程度
盐、醚、酯 制药公司总是试图为已知的活性成份的一种新的盐申请专利。
药物前体和代谢物
药物前体应用的另一个重要例子是肿瘤的化疗药物。这些药物前体的代谢产物具有 超高毒性。在缺氧的肿瘤细胞内存在大量还原酶,而这些还原酶能将药物前体转化为毒性 的代谢产物。而正常细胞不处在缺氧状态,所含还原酶的量也较少,因此这些药物前体对 于正常细胞的毒性作用就弱。
商业运作
商业运作获得成功有如下三条基本原则: (1)能够推动广泛而优化的病人处方机会。 (2)能够保护并维持市场可及性和医保医院进药。 (3)能够提升品牌的利润率。
罗氏联合基因泰克(Genentech)和日本中外制药(Chugai)……
武田公司(Takeda)通过一系列在产品层面的合作扩大了其在美国市场的销量并实 现全球扩张。其与雅培制药组成的合资公司使抑那通(Lupron)和达克普隆(Prevacid)等主 要产品获得了美国市场。
致力于区域扩张的另一个日 本公司是第一三共。它对印度仿制药生产商兰伯西(Ranbaxy)的收购虽然给其管理团队带 来不少挑战,但是兰伯西在全球的分销网络大大提高了其在全球市场上市产品的速度。
定价
影响品牌定价策略的主要有以下三个因素: ·所处产品生命的阶段(上市、增长期或专利过期阶段)。 ·品牌的区域重点,以及在每个国家不同利益相关人的影响。 ·产品差异化程度和竞争对手的策略。
退市
退出市场原因1:病人安全
退出市场原因2:公司战略转型
退出市场原因3:利润滑坡
退出市场原因4:现金需求
生物药
安进 (Amgen)、百健艾迪(BiogenIdec)、新基医药(Celgene)、凯龙(Chiron)、基因泰克 (Genentech)、健赞(Genzyme)和Immunex这样年轻而具有旺盛活力的小型生物制药公司。
罗氏收购基因泰克,安进收购Immunex,以及雅培通过Knoll公司的收购
根据FDA的定义,生物制品包括: ·过敏原检测产品(过敏原斑贴试验、过敏原提取物) ·血液和血液制品(全血、成分血、血站用器具、献血者筛查试验) ·细胞和基因治疗产品(基因疗法、细胞疗法、克隆) ·组织和组织产品(骨骼、皮肤、角膜、肌腱、干细胞、精子、心瓣膜) ·疫苗(成人和儿童应用疫苗、结核菌素试验) ·异种移植(将非人类的细胞、组织或器官移植给人体)
自行注射装置随着第一支胰岛素笔于1984年问世而逐渐得到广泛关注。现如今,像来 得时Solostar(LantusSolostar)这样的品牌胰岛素笔通过让病人自我管理疾病,扩大品牌药 的市场份额并提高品牌忠诚度。
在小分子(化学)制药领域,只要采用相同的化学合成方法和步骤,就可以生产出与目 标产品完全相同的分子,并且只要用简单的检测法就能证明两者确实完全相同。而生物药 品的生产过程不仅比化学制药过程复杂得多,而且其最终产品的理化、药理性质对于生产 过程的一些参数,例如细胞株的选择、发酵温度、纯化的条件等均十分敏感,因此生物仿制 药公司要完全复制原研药公司的生产过程几乎是不可能完成的任务。 此外,现有的技术也无法证明两个生物药品是完全相同的产品。即使投人大量的费用 去完成一个新药上市所需做的临床研究也不能证明两个生物药品完全相同,而只能证明两 者是相似的。因此生物仿制药又被称为生物类似药。
生物仿制药是仿制药的一种,但是和传统意义上的仿制药相比,生物 仿制药的研发、生产和商业运作所需的技能有很大不同。从生产、研发和市场监管的角度 来看,生物仿制药行业与原研生物药品公司更接近,而与传统仿制药公司迥然不同。